Rezistencia antibiotík (Antimicrobial Resistance, AMR) je rozšírený jav, pri ktorom antibiotiká prestávajú byť účinné (citlivé) na liečbu pôvodcov infekčných ochorení, baktérie nadobúdajú voči antibiotikám odolnosť. Rezistencia síce nie je žiadna nová skutočnosť, ale jej význam z viacerých dôvodov narastá. Jednak sa neustále zvyšuje jej celkový rozsah a na druhej strane neboli objavené nové antibiotiká, ktoré by mohli byť nasadené namiesto tých, voči ktorým sa vyvinula rezistencia antibiotík.
| Antibiotikum | Objav | Uvedené do klinickej praxe | Objav rezistencie |
| Penicilín | 1928 | 1943 | 1940 |
| Streptomycín | 1944 | 1947 | 1959 |
| Tetracyklín | 1948 | 1952 | 1953 |
| Erytromycín | 1952 | 1955 | 1956 |
| Vankomycín | 1956 | 1972 | 1987 |
| Gentamycín | 1963 | 1967 | 1970 |
| Linezolid | 1996 | 2000 | 2001 |
Mechanizmus šírenia rezistencie spočíva v génoch, ktoré ochránia baktériu pred účinkom antibiotika. Týchto génov je veľké množstvo a vďaka tzv. plazmidom (krátke úseky DNA, ktoré nie sú súčasťou bunkového jadra a baktérie si ich môžu navzájom vymieňať) sa môžu pomerne rýchlo šíriť aj medzi rôznymi druhmi baktérii. V prostredí s antibiotikom teda baktérie bez génov pre rezistenciu zahynú, výsledkom selekcie je, že prežijú iba rezistentné baktérie a ich ďalšie generácie si zachovajú rezistenciu – proces šírenia rezistencie je podmienený evolučne. Baktérie môžu mať viac rôznych génov pre rezistenciu voči viacerým antibiotikám (čo je aj pomerne bežné), v tomto prípade hovoríme o multirezistencii. Jednotlivé gény (resp. enzýmy ktoré dané gény kódujú) môžu zabezpečovať rezistenciu rôznymi mechanizmami (napríklad chemicky rozložia molekulu antibiotika, zabránia jeho vzniku do bakteriálnej bunky, zabezpečia vylúčenie antibiotika z bakteriálnej bunky, zmenia metabolické dráhy tak, že do nich antibiotikum nevstupuje).
Podľa toho aký gén pre rezistenciu, alebo kombinácia génov, je v bakteriálnej bunke, nemusí byť rezistencia úplná, ale iba zníži citlivosť voči antibiotiku (“intermediárna citlivosť“, skratka “I“). Aj preto je používaná hodnota MIC (Minimum Inhibitiry Concentration) – minimálna inhibičná koncentrácia, ktorá určuje aká koncentrácia antibiotika je potrebná na zastavenie rastu pri laboratórnej kultivácii. Tieto hodnoty sa štandardne uvádzajú pri mikrobiologických vyšetreniach. Čím je hodnota vyššia, tým viac antibiotika je potrebného na zastavenie rastu baktérii, resp. liečbu infekcie, tým je baktéria pre dané antibiotikum rezistentnejšia.
Evolučný charakter šírenia rezistencie je tiež odpoveďou prečo je rezistenciu ťažké eliminovať – DNA z plazmidov sa môže integrovať do bunkového jadra a potom sa prenáša na všetky nasledujúce bakteriálne generácie. Keď sa však niektoré antibiotikum prestane v klinickej praxi používať, s odstupom času predsa len dochádza k pozvoľnému znižovaniu rezistencie voči nemu. Gény ktoré neprinášajú nositeľovi – baktérii žiadnu výhodu pre prežitie sa síce pomaly, ale predsa z bakteriálnej populácie vytrácajú. Jeden gén spravidla zabezpečí baktérii rezistenciu voči viacerým, chemicky príbuzným antibiotikám, čo sa označuje ako skrížená rezistencia. Napríklad ak je baktéria rezistentná voči erytromycínu (ktorý sa spravidla používa pri laboratórnych testoch), bude to znamenať rezistenciu aj voči ostatným makrolidovým antibiotikám (napríklad terapeuticky často používanému azitromycínu).
Miera rezistencie je preto dobrým obrazom aké antibiotiká sa kde a kedy najviac používajú. Preto napríklad klesá rezistencia voči sulfónamidom, keďže sa v klinickej praxi už menej používajú, alebo naopak je nízka rezistencia voči novým a drahým antibiotikám (napr. linezolidu) v rozvojových krajinách, napriek tomu, že pri množstve antibiotík je v daných krajinách rezistencia vysoká. Z pohľadu geografického rozšírenia celkovej, alebo priemernej rezistencie je možné vytvoriť určité, veľmi približné zovšeobecnenia. Charakter rezistencie určuje vo veľkej miere spotreba antibiotík a spravidla je možné pozorovať určitý vzťah medzi úrovňou zdravotníctva a antibiotickou rezistenciou. V rámci Európy je najnižšia rezistencia v severských krajinách, naopak vyššia je v južnej a východnej Európe. Podobne z celosvetového pohľadu je miera rezistencie nízka v USA (približne na úrovni Európy), oproti tomu situácia je najhoršia v rozvojových krajinách. Preto aj cestovanie do oblastí s vysokou mierou rezistencie môže pre ohrozené osoby predstavovať zdravotné riziko – možnosť infekcie multirezistentnými kmeňmi.
Rezistencia antibiotík bola až približne do 90-tych rokov minulého storočia skôr okrajovým problémom. Dovtedy vývoj nových antibiotík držal krok s rozvojom rezistencie. Počet nových antibiotík uvedených na trh sa postupne začal znižovať, niektoré antibiotiká boli tiež stiahnuté z trhu kvôli nežiadúcim účinkom (napr. temafloxacin, gatifloxacin). Prevláda názor, že hlavným dôvodom nedostatku nových antibiotík je, že všetky dôležité antibiotiká už boli objavené a teda zvrat v podobe vývoja nových molekúl ani nie je možné očakávať. Začalo byť zrejmé, že nová situácia si vyžaduje nové stratégie, ktoré by dokázali riešiť vynárajúci sa kritický problém – možnosť, že antibiotiká prestanú byť efektívnou antimikrobiálnou liečbou, čo sa tiež označuje ako “postantibiotická éra“. V skutočnosti antibiotiká nie sú jedinými antiinfekčnými liečivami, alternatívou môže byť vývoj nových vakcín a tiež moderné lieky využívajúce monoklonálne protilátky. V súčasnosti prebieha tiež výskum na vývoji vakcíny proti Pseudomonas aeruginosa, doposiaľ však bez väčších úspechov [1].
Zatiaľ však antibiotiká zohrávajú v klinickej praxi zásadný význam a sú potrebné opatrenia na predĺženie ich použiteľnosti, teda zabráneniu rozsiahlej multirezistencie. Kľúčom k dosiahnutiu tohto cieľa má byť racionálne využívanie antibiotík a zníženie ich spotreby (okrem využitia v medicíne sa v značnom rozsahu antibiotiká kontroverzne používajú aj v poľnohospodárstve). Tieto zásady racionálneho používania boli písomne formulované ako odporúčania, dôležité organizácie v tomto smere sú Infectious Diseases Society of America (IDSA) a European Society of Clinical Microbiology and Infectios Diseases (ESCMID).Tieto odporúčania zahŕňajú napríklad indikáciu antibiotík na základe laboratórneho vyšetrenia citlivosti, zamedzenie nadspotreby antibiotík (napr. v rámci nemocnice viazať použitie niektorých antibiotík na súhlas terapeutickej komisie), vzdelávanie lekárov o problematike rezistencie, pravidelné zhodnotenia spotreby a citlivosti a ďalšie.
Tieto odporúčania začali byť prijímané vo vyspelých krajinách v 90-tych rokoch. Aj vďaka tomu došlo vo Veľkej Británii v rokoch 1995 – 2000 k historicky prvému významnému zníženiu spotreby antibiotík, približne o 22 %. Od tohto obdobia “reštrikcie” je v krajinách, ktoré opatrenia zaviedli rast rezistencie miernejší. Niektoré štúdie však odhalili riziká znižovania antibiotickej spotreby, ako napr. Price a spol. 2004, ktorá zistila súvislosť medzi zvýšenou mortalitou pri v komunite získanom zápale pľúc a znížením použitím antibiotík [2]. Preto stále platí, že komplikovaný problém antibiotickej rezistencie je zásadnou hrozbou verejného zdravotníctva a jej význam bude v najbližších rokoch iba rásť. Kam tento vývoj môže smerovať predostrela štúdia publikovaná v decembri 2015 [3]. Tá odhaduje, že do roku 2050 môže rezistencia antibiotík viesť každoročne k 10 miliónom úmrtí (v súčasnosti je to okolo 700 000) a k celkovým ekonomickým škodám v rozsahu 100 miliárd dolárov, relatívne bežné chirurgické zákroky môžu byť znovu životu nebezpečnými. Najhoršie dôsledky sa očakávajú v chudobných krajinách – v Ázii a Afrike. Dôsledky by však mali byť miernejšie pokiaľ vedecký pokrok v danej oblasti prinesie nové, zatiaľ nepoznané riešenia.
V súčasnosti sú už k dispozícii rozsiahle datasety údajov o antibiotickej rezistencii, ktorých zdrojom sú mikrobiologické laboratóriá, ktoré sumarizované výsledky laboratórnych vyšetrení odosielajú do centrálnych databáz. To umožňuje lepšie vyhodnotenie, sledovanie trendov a účinnosti opatrení proti šíreniu rezistencie. Pri týchto štatistikách (niektoré sú uvedené nižšie v tomto článku), je potrebné si uvedomiť ich viaceré obmedzenia (“štatistika je presný súčet nepresných čísel“). Na to aby mohli byť údaje porovnateľné musia byť v prvom rade štandardizované – všade by mal byť postup pri laboratórnom vyšetrení rovnaký. Aj keď posun v harmonizácii pravidiel je značný, napríklad aj hodnoty MIC, ktoré sa považujú za hranicu rezistencie sa medzi jednotlivými laboratóriami v niektorých prípadoch líšili, takže dve laboratória by mohli vyhodnotiť tú istú vzorku odlišne. Aj ak by bola však metodika všade rovnaká, ostávajú faktory ktoré nevyhnutne majú vplyv na štatistické výsledky. Napríklad dostupnosť a väčšie využitie laboratórneho testovania citlivosti v praxi znamená, že zatiaľ čo predtým sa antibiotická citlivosť testovala najmä v najťažších prípadoch (napríklad nozokomiálnych infekcií, kde zvykne byť rezistencia vysoká), ak je teraz zastúpenie “bežných prípadov“ väčšie tak relatívne (percentuálne) klesne počet vyšetrení so zistenou multirezistenciou, čo vytvorí falošný dojem že multirezistentné kmeňe sú na ústupe. Inak povedané, niektoré “ekosystémy“ baktérii sú sledované viac ako ostatné, týchto “ekosystémov“ je veľa a ich vzájomné vzťahy sú komplikované a snaha opísať ho jedných číslom (percentom rezistencie) je do istej miery užitočné, ale nevyhnutne tiež zjednodušujúce, nevystihujúce komplexnosť problému.
Rezistencia u baktérii s významom pri cystickej fibróze
Antibiotiká patria pri CF medzi najpoužívanejšie liečivá a chronické infekcie sa vyskytujú prakticky u všetkých CF pacientov. Preto je problematika antibiotickej rezistencie pre CF veľmi dôležitá, vývoj v tejto oblasti zásadne ovplyvní aj celkovú prognózu CF liečby. Inak povedané v prípade rýchleho šírenia multirezistencie hrozí, že niektoré pokroky v liečbe budú zvrátené.
Pri CF sa vyskytujú najmä infekcie baktériami: Staphylococcus aureus, Haemophilus influenzae, Pseudomonas aeruginosa, Burkholderia cepacia, Achromobacter xylosoxidans. Prvé tri menované majú všeobecne v klinickej mikrobiológii značný význam (t.j. aj pri iných ochoreniach ako CF) a z toho dôvodu je ich rezistencia sledovaná a je k dispozícii dostatok údajov. Oproti tomu B. cepacia a A. xylosoxidans sú významnými patogénmi iba pri CF a aj v CF populácii je ich výskyt obmedzený, preto je počet kultivácii resp. údajov o rezistencii celkovo nízky. Klinicky najväčší význam pri CF majú infekcie P. aeruginosa a B. cepacia, zatiaľ čo infekcie P. aeruginosa sú u CF pacientov bežné, infekcia B. cepacia je pomerne zriedkavá, ale viac nebezpečná. Pri CF liečbe je kladený dôraz na preventívne opatrenia – zabránenie týchto infekcii a za týmto účelom boli vypracované špecifické medicínske odporúčania [4, 5].
Staphylococcus aureus (SA)
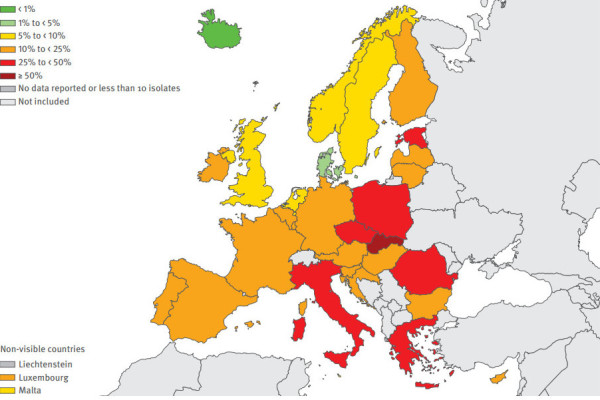
Je veľmi rozšírená baktéria, ktorá bežne vyvoláva rôzne infekčné ochorenia, pričom pri CF má najväčší význam infekcia pľúc. Chronické infekcie SA, ktoré sú pri CF pomerne časté, preukázateľne zhoršujú priebeh a prognózu ochorenia, napriek tomu, že iba veľmi zriedkavo vyvoláva závažnejšie akútne komplikácie. Mimoriadne nebezpečným kmeňom je Meticilín rezistentný SA (MRSA) ktorý je rezistentný voči penicilínom a cefolosporínom. Často sa šíri ako nemocničná (nozokomiálna) nákaza. Slovensko patrí medzí EU krajiny s najvyšším výskytom MRSA.
Výskyt MRSA, ECDC Antimicrobial resistance surveillance in Europe 2013 [6]:
Pseudomonas aeruginosa (PA)
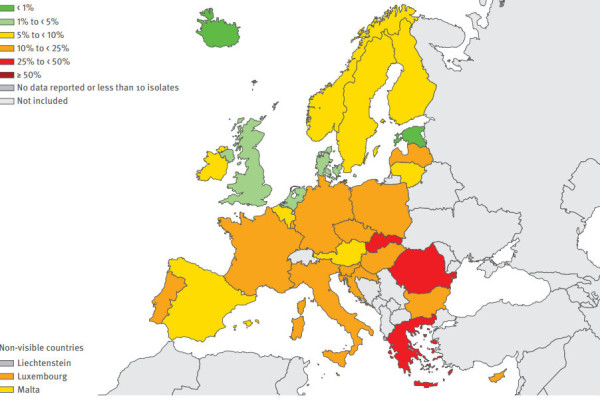
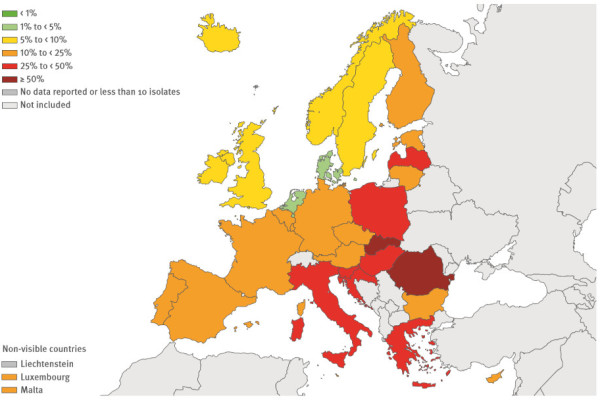
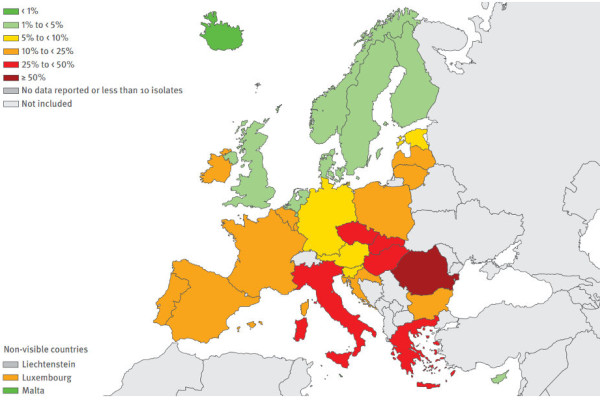
Je v prírode bežne rozšírená baktéria, ktorá spôsobuje u CF pacientov pomerne závažné chronické pľúcne infekcie. Infikovaná je väčšina CF pacientov. Vo všeobecnosti platí, že nemocničné (nozokomiálne) PA nákazy (ktoré sú mimochodom pomerne časté) sú nebezpečnejšie ako infekcie z ostatného prostredia, pretože práve kmene rozšírené v nemocniciach zvyknú mať najvyššiu mieru rezistencie. Aj v súvislosti so segregáciou – zamedzení vzájomného kontaktu pacientov ako opatrenia proti prenosu infekcie, pochopiteľne platí, že aj pacient ktorý už má PA infekciu sa môže infikovať ďalším PA kmeňom, ktorý ak je rezistentnejší bude preňho nebezpečnejší. Ak sa PA infekciu nepodarí hneď na začiatku eliminovať, tak sa stáva chronickou a vedie k rýchlejšiemu a trvalému zhoršovaniu zdravotného stavu. Možnosti liečby PA sú dosť obmedzené, keďže baktéria je odolná proti množstvu antibiotík a aj u tých voči ktorým bola citlivá sa rýchlo šíri rezistencia. Aj v tomto prípade je žiaľ situácia v SR nepriaznivá, keďže miera rezistencie je v porovnaní s ostatnými európskymi krajinami veľmi vysoká. V prípade napríklad fluorochinolónov najhoršia z celej Európy.
Rezistencia Pseudomonas aeruginosa voči vybraným antibiotikám, všetky diagnózy (fluorochinolóny – napr. ciprofloxacín, aminoglykozidy – napr. tobramycín, karbapenemy – napr. imipenem), ECDC Antimicrobial resistance surveillance in Europe 2013 [6]:
V tabuľkách nižšie sú údaje PA rezistencie v SR (z databázy SNARS Úradu verejného zdravotníctva), pričom z týchto údajov je zrejmé, že PA rezistencia má celkovo klesajúci trend. To platí tak pre štatistiku všetkých vyšetrení ako aj pre výsledky odfiltrované pre CF (dg. E84). Klesajúce miera PA rezistencie nie je v rámci Európy typická, ale podobný vývoj je aj v niektorých ďalších krajinách (napr. vo Francúzsku a v Českej republike, voči väčšine antibiotík klesá PA rezistencia aj vo Veľkej Británii, Grécku). Ako bolo uvedené vyššie, na týchto výsledkoch sa do istej miery môžu podieľať aj niektoré štatistické skreslenia. Aj keď trend poklesu rezistencie je samozrejme potešiteľný, stále platí, že situácia je aj tak v porovnaní s ostatnými krajinami Európy nepriaznivá.
Trend vývoja antibiotickej rezistencie Pseudomonas aeruginosa v SR (v %, všetky diagnózy) [7]:
Tento vývoj je kopírovaný aj v prípade CF pacientov, štatisticky sa celková rezistencia znižuje. Je vhodné poznamenať že pacient, ktorý už má rezistentnú formu PA infekcie nemôže realisticky očakávať, že tá bude vyliečená (bez ohľadu na to, či je štatistika rezistencie klesajúca). Posun v celkovej, štatisticky vykázanej rezistencii môže byť iba dôsledkom napr. diagnostikovania nových pacientov, ktorý sú infikovaný menej rezistentnými PA kmeňmi, resp. úmrtím starších pacientov, ktorí naopak majú multirezistentné infekcie. Špecifickým faktorom pri CF, ktorý by čiastočne mohol vysvetľovať tento pokles môže byť účinok spomínaných opatrení na zamedzenie šírenie infekcií. Tieto opatrenia sa začali zavádzať pred niečo viac ako 10 rokmi, ale ich predpokladaný efekt je dlhodobý, je ho možné pozorovať až po väčšom časovom odstupe, aspoň tak to naznačujú niektoré zahraničné štúdie, ktoré skúmali do akej miery sú v praxi tieto opatrenia účinné. Vo všeobecnosti, bez ohľadu na štatistiku je pohľad lekárov taký, že situácia s rezistenciou sa pri CF neustále zhoršuje.
Trend vývoja antibiotickej rezistencie Pseudomonas aeruginosa v SR (v %, iba laboratórne vyšetrenia pri diagnóze E84 – CF) [7]:
[1] Vaccines for preventing infection with Pseudomonas aeruginosa in cystic fibrosis [2] Price D.B., Honeybourne D., Little P., Mayon-White R.T., Read R.C. a spol.; Community- acquired pneumonia mortality: a potential link to antibiotic prescribing trends in general practice; Respiratory Medicine 2004; 98; 17-24 [3] Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations [4] http://www.cysticfibrosis.org.uk/media/82064/pseudomonas-aeruginosa-infection-nov-04.pdf [5] http://www.cysticfibrosis.org.uk/media/82022/burkholderia-cepacia-sept04.pdf [6] Antibiotic resistance surveillance in Europe, European Centre for Disease Prevention and Control, 2013 [7] Slovak National Antimicrobial Resistance System